Rating: 4.5
 a.
Atom merupakan bagian terkecil dair suatu
zat yang tidak dapat dibagi lagi secara reaksi kimia biasa
a.
Atom merupakan bagian terkecil dair suatu
zat yang tidak dapat dibagi lagi secara reaksi kimia biasa
A. ATOM
· Atom adalah
bagian terkecil dari suatu unsur yang masih memiliki sifat unsur tersebut.
· Setiap atom dari
suatu unsur memiliki sifat tertentu yang berbeda dengan sifat atom unsur yang
lain. Perbedaan ini meliputi sifat kimia dan sifat fisiknya.
· Perbedaan antaratom terjadi karena perbedaan jumlah proton, elektron, dan
neutron penyusunnya.
1.
Demokritus
→ atom merupakan partikel paling kecil yang tidak dapat
dibagi lagi.
 a.
Atom merupakan bagian terkecil dair suatu
zat yang tidak dapat dibagi lagi secara reaksi kimia biasa
a.
Atom merupakan bagian terkecil dair suatu
zat yang tidak dapat dibagi lagi secara reaksi kimia biasa
b.
Atom suatu unsur tidak dapat berubah
menjadi atom unsur lain
3.
J. J. Thomson
a.
Atom seperti roti kismis
b.
Atom merupakan bola pejal yang terdiri
dari muatan positif (proton) dan muatan negatif (elektron) yang tersebar merata
di seluruh bagian atom
a.
Atom terdiri dari inti atom yang
bermuatan positif
b.
Elektron tersebar merata mengelilingi
inti atom
c.
Atom bersifat netral karena jumlah proton
= jumlah elektron
d.
Inti atom dan elektron tetap berada dalam
lintasannya.
5.
Niels Bohr
a.
Atom terdiri dari proton (+), neutron (netral),
dan elektron (-).
b.
Inti atom tersusun atas protondan neutron
c.
Elektron bergerak mengelilingi inti atom
dengan gaya inti, sehingga elektron tetap berada dalam lintasannya.
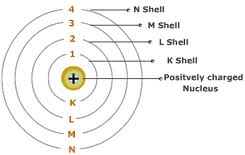
Menurut
Bohr, dalam atom terdapat lintasan stasioner dengan tingkat energi tertentu
dimana elektron dapat beredar mengitari inti tanpa disertai pemancaran dan
penyerapan energi. Lintasan ini disebut kuit
atom, yaitu orbit berbentuk lingkaran dengan jari-jari tertentu.
Tiap
lintasan ditandai dengan satu bilangan bulat yang disebut bilangan kuantum utama (n) mulai dari 1, 2, 3, 4, dan seterusnya,
dan diberi lambang K, L, M, N, dan seterusnya.
Lintasan
pertama, harga n=1, disebut kulit K.
Lintasan
kedua, harga n=2, disebut kulit L,dst.
Semakin
besar harga n (semakin jauh dari
inti), semakin banyak elektron yang mengorbit pada kulit itu.
Banyaknya
elektron pada tiap kulit: 2n2.
→ mempunyai
persamaan dengan model atom Bohr dalam hal tingkat energi. Perbedaannya
terletak pada bentuk lintasan elektron.
Bohr menggunakan lintasan elektron berupa lingkaran
dengan jari-jari tertentu, sedangkan model mekanika kuantum menggambarkannya berupa orbital.
Dari ke-6 teori atom di atas,model atom Bohr-lah yang
dianggap benar dan paling mudah dipahami dan dibayangkan.
Partikel
Subatomik
1.
Proton
· Ditemukan elh Goldstein (1886) dan diperkuat oleh Rutherford (1991).
· Bermuatan positif, ditulis dengan lambang p
· Muatan listriknya + 1,6 x 10-19 coulomb
· Massa proton 1,673 x 10-24 gram
· Terletak di tengah atom dan bersama neutron menyusun inti atom.
2.
Elektron
· ditemukan oleh Joseph John Thomson (1897)
· bermuatan negatif, ditulis dengan lambang e
· muatan listriknya - 1,6 x 10-19 coulomb
· Massa elektron 9,1 x 10-28 gram
· Elektron inilah yang berperan aktif dalam reaksi kimia
3.
Neutron
· ditemukan olah James Chadwick (1932)
· tidak bermuatan (netral), ditulis dengan lambang n
· Massa netron 1,675 x 10-24 gram
· Jumlah netron sangat berpengaruh pada massa suatu atom
Nomor
Atom dan Nomor Massa
 |
||
X
|
:
|
Lambang unsur
|
A
|
:
|
Nomor massa = jml
proton dan neutron
|
Z
|
:
|
Nomor atom = jumlah
proton = jumlah elektron
|
Contoh:
Unsur
natrium dapat dituliskan dengan notasinya 
Artinya
natrium memiliki nomor atom 11 dan nomor massa 23.
Atom
ini memiliki jumlah proton dan elektron yang sama yaitu 11.
Jumlah
neutron dapat dihitung dengan rumus A – Z atau 23-11 = 12